Phenylalanin-Desaminierungstest an Bakterien, um herauszufinden, ob sie die Aminosäure desaminieren kann (mit Abbildung)
Lesen Sie diesen Artikel, um mehr über den Phenylalanin-Desaminierungstest an Bakterien zu erfahren, um herauszufinden, wie sie die Aminosäure desaminieren kann!
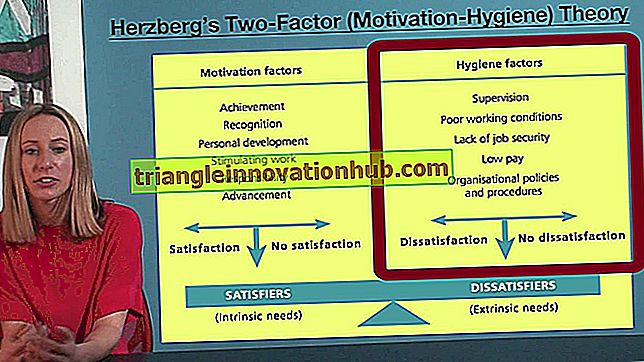
Prinzip:
Einige Bakterien haben die Fähigkeit, die Aminosäure Phenylalanin zu desaminieren, da sie das Enzym "Phenylalanin-Deaminase" produzieren können.
Dieses Enzym desaminiert Phenylalanin durch Entfernung seiner Aminogruppe, wodurch Phenylbrenztraubensäure (eine Ketosäure) und Ammoniak (NH 3 ) erzeugt wird. Phenylbrenztraubensäure bildet mit Eisenchloridlösung grüne Farbe.
Im Phenylalanin-Desaminase-Test wird das Testbakterium auf Agarschrägen gezüchtet, die Phenylalanin enthalten. Wenn die Bakterien die Fähigkeit haben, Phenylalanin zu desaminieren, ändert sich die Farbe der Schrägen von gelb nach grün, wenn Eisen (III) -chloridlösung darauf getropft wird.
Erforderliche Materialien:
Reagenzgläser, Erlenmeyerkolben, Wattestopfen, Impföse, Autoklav, Bunsenbrenner, Laminar-Flow-Kammer, Entsorgungsglas, Inkubator, Phenylalanin-Agar, Eisenchloridlösung (10%), isolierte Kolonien oder Reinkulturen von Bakterien.
Verfahren:
1. Die Bestandteile des Phenylalanin-Agarmediums (das Phenylalanin als Hauptbestandteile enthält) oder seines gebrauchsfertigen Pulvers, das für 100 ml des Mediums erforderlich ist, werden abgewogen und in 100 ml destilliertem Wasser in einem 250-ml-Erlenmeyerkolben durch Schütteln und Verwirbeln gelöst ( Abbildung 7.17).

2. Sein pH-Wert wird unter Verwendung eines pH-Papiers oder eines pH-Meters bestimmt und mit 0, 1 N HCl auf 7, 2 eingestellt, wenn der pH-Wert höher ist, oder mit 0, 1 N NaOH, wenn es weniger ist.
3. Der Kolben wird erhitzt, um den Agar vollständig in dem Medium aufzulösen.
4. Bevor es sich verfestigt, wird das Medium in warmem geschmolzenem Zustand in 5 Teströhrchen (jeweils ca. 20 ml) verteilt.
5. Die Reagenzgläser sind mit Baumwolle verstopft, mit Bastelpapier bedeckt und mit Faden oder Gummiband gebunden.
6. Sie werden bei 121 ° C (15 psi Druck) 15 Minuten in einem Autoklaven sterilisiert.
7. Nach der Sterilisation werden sie aus dem Autoklaven genommen und in einer schrägen Position gehalten, um das Medium abzukühlen und zu verfestigen, um Phenylalanin-Agar-Schrägen zu erhalten.
8. Die Testbakterien werden aseptisch, vorzugsweise in einer Laminar-Flow-Kammer, durch Streifen auf der Oberfläche der Schrägen mit Hilfe einer flammsterilisierten Schleife inokuliert. Die Schlaufe wird nach jeder Impfung sterilisiert.
9. Die inokulierten Schrägen werden 24 bis 48 Stunden bei 37 ° C in einem Inkubator inkubiert.
Zu jeder Schräge werden 4-5 Tropfen Eisen (III) -chlorid-Lösung (10%) zugegeben.
Beobachtungen:
1. Farbe der Neigung ändert sich in gewachsen. Phenylalanindeaminase positiv.
2. Farbe der Schräge bleibt gelb: Phenylalanin-Deaminase-negativ.